May 3, 2017 | Matteo M. – trad. Alexander S.
Damit die Korallen optimal wachsen, müssen viele chemische und physikalische Bedingungen optimal sein. Dana Riddle hat einen interessanten Artikel über Advanced Aquarist veröffentlicht, in dem er die Auswirkungen des gelösten Bikarbonates auf die Photosynthese und auf das Wachstum der Korallen untersucht.
Für die Neugierigen ist der vollständige Artikel (in Englisch) unter dieser Adresse zu finden.
Die Photosynthese ist die Verbindung zwischen der anorganischen und organischen Welt, und die Tätigkeit der Zooxanthellen ist von größter Bedeutung für die Gesundheit der Korallen.
Die Photosynthese ist abhängig von der Menge des Lichts, von seinem Spektrum und von der Quelle der Nährstoffe (für Landpflanzen, um es verständlicher zu machen, die „Quelle von Nährstoffen“ wird im Allgemeinen mit Stickstoff, Kalium und Phosphor definiert, mit „Mikronährstoffen“ wie Eisen, Kupfer und viele andere). Obwohl der anorganische Kohlenstoff (in Form von Kohlendioxid) nicht als Quelle angegeben wird, ist er ein wichtiger Nährstoff für das Pflanzenwachstum und für die Produktion von einfachen Zucker notwendig.
Im Meerwasseraquarium sind Nährstoffe wie Stickstoff und Phosphor in der Regel in so großer Menge vorhanden, dass es oft notwendig ist, sie zu verringern. Kalium ist außerdem mit einer Konzentration von etwa 400 mg / l eine gute Quelle für Nährstoffe. Viele Mikronährstoffe könnten durch Fütterung oder normale Wasserwechsel hinzugefügt oder rekonstituiert werden.

Wie sieht es aber mit dem Co2 aus? Auch wenn eine bestimmte Menge von Kohlendioxid in einem Aquarium vorhanden sein kann und einen Teil für die Photosynthese der Zooxanthellen erforderlichen Kohlenstoffbedarf befriedigt, gibt es Hinweise darauf, dass in vielen Fällen der restliche Anteil Kohlenstoff durch den im Wasser gelösten Bicarbonat bereitgestellt wird.
Das Gesetz von Liebig besagt, dass die Photosynthese nicht durch die Konzentration des am häufigsten vorkommendes Nährstoffes gesteuert wird, sondern von der Verfügbarkeit des am wenigsten vorkommendes Nährstoffes. Diese Tatsache kennen die Fans von Süßwasserpflanzen gut. Ernährungsbedingte Zusätze werden normalerweise durchgeführt, um die allgemeine Krankheit von Pflanzen, die als Chlorose bekannt ist, zu verhindern.
Im Meerwasseraquarien sollte regelmäßig der Alkali-Gehalt überwacht werden, da er aus mehreren Gründen wichtig ist. Um eine einfache Definition zu geben, ist er Alkali-Gehalt ist die Fähigkeit einer Lösung, Säuren zu neutralisieren. Er kann auf verschiedene Arten gemessen werden (meq / L, ppm, mg / L als Calciumcarbonat – CaCO 3), aber die Karbonat-härte (dKH) ist der Standard in der Aquarienwelt.
Der Alkali-Gehalt wirkt daher als Puffer gegen eine Verschiebung des pH-Wertes nach unten, was sehr wichtig ist, da der Nitrifikationsprozess, der normalerweise im Aquarium auftritt, ihn senkt. Carbonate und Kalzium sind auch wesentlich für die Bildung von Strukturen (Skeletten) von Hartkorallen.
Welche Bedeutung hat der Alkali-Gehalt im Vergleich zu einer anorganischen Kohlenstoffquelle für die Photosynthese? Um diese Frage zu beantworten, wurden verschiedene Experimente durchgeführt, um die Hypothese zu überprüfen, dass Carbonat-konzentrationen die Photosynthese-Aktivität beeinflussen können.
Die photosynthetische Aktivität kann durch den Parameter „rETR“(relative elektronische Transportrate) quantifiziert werden. Die elektronische Transportrate (ETR) ist ein Maß für die Photosynthese-Leistung. Die Lichtteilchen (Photonen), die einmal von Fotopigmenten (z. B. Chlorophyll) absorbiert wurden, werden zu Elektronen und fließen (normalerweise) zwischen den Fotosystemen.

Ein niedriger ETR bedeutet eine niedrige Photosynthese-Rate; Ein hoher ETR bedeutet eine hohe Rate. Wenn die Absorption von Licht gemessen wird, wird der Elektronenfluss ETR genannt. Andernfalls wird relative elektronische Transportrate oder als rETR genannt.
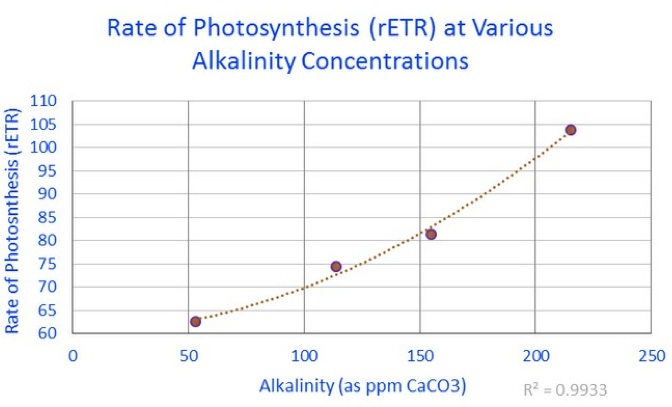
zur Klarheit: 53 ppm = 2.968 dKH; 114 = 6.384; 155 = 8.68 and 215 = 12.04
Das vorherige Diagramm zeigt die rETR-Messungen, die mit der Aktivität von Zooxanthellen innerhalb einer „Porites Lobata“-Koralle bei verschiedenen Alkali-Konzentrationen in einer experimentellen Umgebung verbunden sind.
Das Ergebnis dieser Experimente zeigte, dass die Photosynthese-Rate durch Erhöhen des Alkali-Gehaltes von einem „normalen“ Niveau (6,4 dKH) auf ein hohes Niveau (12 dKH) um etwa 29% erhöht werden konnte.
Die Bedeutung von Carbonaten als anorganische Kohlenstoffquelle für die Photosynthese könnte uns überraschen: Auch wenn wir Korallen als relativ einfache Kreaturen betrachten, kann die Biochemie, die an ihren Lebensprozessen beteiligt ist, alles andere als einfach sein. Darüber hinaus gibt es einige Ähnlichkeiten mit dem Metabolismus anderer Tiere und damit auch des Menschen.

Die Verwendung von Bicarbonat (HCO3-) als eine anorganische Kohlenstoffquelle für die Photosynthese hängt hauptsachlich von 2 Faktoren ab: ein Enzym, die Carboanhydrase (interne und externe) und der „aktiven Bicarbonat-Transport“.
Tatsächlich findet sich im Korallengewebe ein Enzym, die Carboanhydrase (CAH oder CA in englisch), das auch in den roten Blutkörperchen und in den Mesophilen von Pflanzen vorhanden ist, dessen Aufgabe es ist, als Katalysator für die Reaktion zwischen Kohlendioxid CO2) und Wasser (H2O) zu Kohlensäure (H2CO3) und dessen Umkehrreaktion, von Kohlensäure zu Wasser und Kohlendioxid zu wirken, nach der chemischen Gleichung:
HCO3- + H+ ↔ CO2 + H2O
Die Richtung, in der die Reaktion stattfindet, hängt von der Konzentration von CO2 ab: Wenn sie niedrig ist (wie in unseren Lungen), wird die Säure verlegt und Kohlendioxid wird freigesetzt; Ist dies der Fall, bindet sich das Anhydrid an das Wasser, das Carbonate bildet, und diese werden dann zum Gewebe (oder in unserem Fall vom Blut in die Lunge) transportiert. Zu vertiefen:
Wie wir vermuten können, könnte dieses Enzym in beiden für die Koralle wichtigen Prozessen nützlich sein: Photosynthese der Zooxanthellen und Verkalkung des Skeletts.
Allerdings passiert Carbonat nicht leicht die Zellwände, aber Kohlendioxid kann es tun. Daher kann eine externe CA das Bicarbonat in Kohlendioxid umwandeln, um einen leichten Durchgang zu ermöglichen. Sobald die Ca in der Zelle ist, wandelt es das Kohlendioxid wieder in Bikarbonat um, um dessen Ausbreitung zu verhindern.
Der andere Prozess, der aktive Bicarbonat-Transport (BAT), verdrängt selektiv das Bicarbonat durch eine Zellmembran, die normalerweise semipermeabel ist. Der BAT wird manchmal Bicarbonat-Pumpe genannt, dieser Prozess kann Bicarbonat-Ionen gegen den Gradienten bewegen.

Der aktive Bicarbonat-Transport (BAT) transportiert das Bikarbonat durch die Mesoglea, wo es erneut von der CA in Kohlendioxid umgewandelt wird. Das Kohlendioxid wird dann verfügbar und wird von Zooxanthellen verwendet.
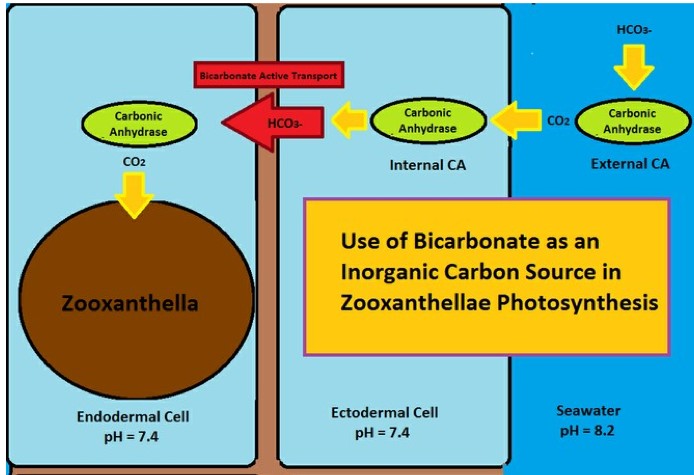
Das äußere Kohlendioxid-Enzym (oben rechts) ist tatsächlich an der ektodermalen Wand der Koralle befestigt, was dieses Bild nicht genau darstellt.
Obwohl dieses Experiment ergab, dass die Photosynthese-Rate in den „porites lobata“ durch die Konzentration von Bicarbonat-Ionen beeinflusst werden könnte, gibt es Hinweise darauf, dass dies bei anderen Korallenarten nicht der Fall ist.
In anderen Studien wurden die anorganischen Kohlenstoffpräferenzen von zwei verschiedenen Zooxanthellen-Familien untersucht und es wurde entdeckt, dass sie sich unterschieden: Einige Zooxanthellen bevorzugen Kohlendioxid aufzunehmen und zu fixieren, während andere auch Bicarbonat verwenden könnten.
Daher können nicht im Voraus Verallgemeinerungen über den Grad der Verwendung von Bikarbonat durch Zooxanthellen gemacht werden.
Eine interessantere Schlussfolgerung könnte sein, dass einige Korallen nicht viele (oder keine) externe Carboanhydrase (CA) Enzyme besitzen. Daher könnte ihre Abhängigkeit vom eingeatmeten Kohlendioxid viel größer sein als jene Korallen, die stattdessen eine externe CA haben. Daraus folgt, dass Korallenwachstumsraten ohne CA geringer sein können als diejenigen, die Bicarbonat als alternative Kohlenstoffquelle nutzen können.

Welche Beziehung besteht zwischen Verbrennungen mit hoher Alkali-Gehalt (Alkalinity Burn) und dem Anstieg der fotosynthetischen Aktivität? „Alkalinity Burn“ ist ein von Aquarianern erfundener Begriff, der auf den Verlust von Geweben normalerweise in der „Spitze“ hinweist, oder im Fall von Acroporidae auf die apikalen und axialen Polypen.
Ist es möglich, dass Chlorophyllkonzentrationen in bestimmten Bereichen und Nebenprodukte der Photosynthese wie Wasserstoffperoxid und Sauerstoffradikale die natürlichen Abwehrkräfte von Enzymen wie Peroxidase und Katalase überlagern? Wie es oft in diesen Fällen beobachtet wurde, ist das Verbrennen der Spitzen in Bereichen, die intensiveres Licht empfangen, vorherrschend, so dass ein hohes Niveau von Bikarbonat die Photosynthese stören könnte, was zur Produktion von verschiedenen Arten von schädlichem Sauerstoff führt, die das Korallengewebe schädigen. Tatsächlich diskutieren einige Studien den Zusammenhang zwischen der Dicke des Korallengewebes und die Schäden, die durch „schädliche Sauerstoffgehalte“ in Verbindung mit der Bewegung von Wasser und der Photosynthese verursacht werden, was sicherlich als synergistischer Effekt des Alkali-Gehaltes zu betrachten ist.
Referenzen:
- Dana Riddle, 2016. How to Grow Corals Quicker: Effects of Various Alkalinity Concentrations on Rates of Zooxanthellae Photosynthesis. Advanced Aquarist
- Al-Moghrabi, S., C. Goiran, D. Allemand, N. Speziale, and J. Jaubert, 1996. Inorganic carbon uptake for photosynthesis by the symbiotic coral-dinoflagellate association. II. Mechanisms for bicarbonate uptake. J. Exp. Mar. Biol. Ecol., 199(2):227-248.
- Brading, P., M. Warner, D. Smith and D. Suggett, 2013. Contrasting modes of inorganic carbon acquisition amongst Symbiodinium (Dinophyceae) phylotypes. New Phytologist, 200(2):432-442.
- Comeau, S., P. J. Edmunds, N. B. Spindel, and R. C. Carpenter 2013b. The responses of eight coral reef calciers to increasing partial pressure of CO2 do not exhibit a tipping point. Limnol. Oceanogr. 58: 388-398.
- Finelli, C., B. Helmuth, N. Pentcheff, and D. Wethey, 2006. Water flow influences oxygen transport and photosynthetic efficiency in corals. Coral Reefs, 25: 47-57.
- Herfort, L., B. Thake, and I. Taubner. 2008. Bicarbonate stimulation of calcication and photosynthesis in two hermatypic corals. J. Phycol. 44: 91-98.
- Jury, C., R. Whitehead, and A. Szmant. 2010. Effects of variations in carbonate chemistry on the calcication rates of Madracis auretenra (Madracis mirabilis sensu Wells, 1973): Bicarbonate concentrations best predict calcication rates. Glob. Chang. Biol. 16: 1632-1644.
- Marubini, F. and B. Thake, 1999. Bicarbonate addition promotes coral growth. Limnol. Oceanogr., 44(3):716-720.
- Marubini, F. and M.J. Atkinson, 1999. Effects of lowered pH and elevated nitrate on coral calcification. Mar. Ecol. Prog. Ser., 188:117-121.
- Wall, C. and P. Edmunds, 2013. In situ effects of low pH and elevated HCO3- on juvenile massive Porites spp. in Moorea, French Polynesia. Biol. Bull. 225: 92-101.
- Zoccola, D., P. Ganot, A. Betucci, N. Caminiti-Segonds, N. Techer, C. Voolstra, M. Aranda, E. Tambutté, D. Allemand, J. Casey, and S. Tambutté, 2015. Bicarbonate transporters in corals point towards a key step in the evolution of cnidarian calcification. Scientific Reports 5, Article number: 9983.



